|
IHC 實驗結果總是忽好忽壞?Abcam IHC 實驗檢查清單幫您把關
西方墨點法 (western blot, WB)、免疫組織化學染色法 (immunohistochemistry, IHC) 與免疫細胞化學染色法 (immunocytochemistry, ICC) 是三種生命科學領域最常使用到的免疫偵測技術。為了協助科研人員更快取得良好的實驗結果,Abcam 技術團隊特別整理出便利的實驗檢查清單,以方便您在實驗過程中能夠隨時掌握關鍵要點,避免疏失與錯誤。 不久前我們曾經分享過【Western Blot 實驗檢查清單】,今天我們則為您帶來【IHC 實驗檢查清單】,歡迎下載使用。以下我們也將一一介紹 IHC 實驗過程中所需注意的操作細節與建議條件。如果懶得爬文,也可以將您手邊的 IHC 疑難雜症直接交給 Abcam 台灣代理伯森生技,將有專人協助您進行疑難排解與實驗最佳化。此外,伯森生技還提供有便利的【IHC 實驗代工服務】,歡迎洽詢索取客製化服務專案內容(👨💻線上聯絡伯森業務專員)。
IHC 實驗流程包含:樣本固定 (Fixation)、包埋與切片 (Embedding & Sectioning)、抗原修復 (Antigen Retrieval)、阻斷 (Blocking)、一級抗體反應 (Primay Antibody Incubation)、二級抗體反應 (Secondary Antibody Incubation)、酵素呈色或螢光檢測 (Chromogenic or Fluorescent Detection) 以及封片 (Mounting) 等步驟。
樣本固定是 IHC 實驗最基礎的一步,可以避免組織離開活體後自溶 (autolysis) 或壞死 (necrosis),使組織抗原性 (antigenicity) 與組織結構能夠被良好地保存下來。樣本固定液可區分為以下兩種:
組織採樣與樣本固定環節的注意事項可總結為以下兩點:
依照組織切片類型,我們將建議的固定、包埋/冷凍處理試劑與條件整理於下表,同時也列出石蠟切片 (paraffin sections)、冷凍切片 (frozen sections) 與浮動切片 (floating sections) 這三種組織切片的優勢與侷限供您參考。
交聯類樣本固定液會促使蛋白質間彼此交聯形成亞甲基橋 (methylene bridges),從而掩蓋抗原表位,限制抗原與抗體間的結合。抗原修復步驟可以打斷亞甲基橋,使被遮蔽的抗原表位重新暴露出來,恢復其抗原性。對石蠟切片來說,抗原修復幾乎是必不可少的步驟;而冷凍切片通常不夠牢固,進行抗原修復可能會造成切片損壞,因此一般會避免使用甲醛固定液(或大幅縮短固定時間),以減少甚至省去抗原修復需求。 抗原修復方法可分為以下兩種: ◾ 酵素/蛋白水解誘導抗原修復法 (proteolytic-induced epitope retrieval, PIER) 使用蛋白酶 (proteases) 進行抗原修復,常用的有蛋白酶 K (proteinase K)、胰蛋白酶 (trypsin) 和胃蛋白酶 (pepsin) 等。此方法通常會破壞組織結構完整性,在一定程度上影響抗原,且修復效果有限,通常用於冷凍切片。操作時,酵素濃度、反應時間和作用溫度均需依據樣本狀態和實驗需求進行測試和優化。 ◾ 熱誘導抗原修復法 (heat-induced epitope retrieval, HIER) 使用高溫(例如:高壓蒸氣、微波、水浴加熱)搭配特定緩衝液進行抗原修復。在熱源的選擇上,由於微波爐加熱可能會有抗原修復不均勻的問題,劇烈沸騰的沸水可能導致脫片,因此高壓蒸氣是 Abcam 較為推薦使用的加熱方法。至於抗原修復液,常見的有較為溫和的 pH 6.0 檸檬酸緩衝液 (citrate buffer) 和較為劇烈的 pH 9.0 Tris-EDTA 緩衝液,在選擇時一般來說取決於目標蛋白質所需的 pH 值,也可以直接參照一級抗體的說明書來進行挑選,例如:Abcam PD-L1 抗體 (ab205921) 即有標明此抗體應用於 IHC 實驗時,建議使用 Universal HIER antigen retrieval reagent (10X) (ab208572) 作為抗原修復液;Ki67 抗體 (ab16667) 則是建議使用 pH 6.0 的檸檬酸鈉緩衝液作為抗原修復液。 您可以在此頁面找尋到所有抗原修復的相關產品。
阻斷是為了避免因非專一性結合而產生的高背景值與偽陽性結果,通常會使用與二級抗體同一宿主來源的正常血清 (normal serum) 作為阻斷液,其他像是含有牛血清白蛋白 (bovine serum albumin, BSA) 或酪蛋白 (casein) 的蛋白質緩衝液也是經常使用的阻斷液。 要特別提醒的是,若是會使用到 DAB 這類經由辣根過氧化物酶 (horseradish peroxidase, HRP) 作用反應的呈色劑時,務必記得要使用 0.3% 過氧化氫 (H₂O₂) 溶液阻斷組織本身的內源性過氧化酶活性;若是使用 BCIP/NBT 這類鹼性磷酸酶 (alkaline phosphatase, AP) 呈色劑時,則是建議在呈色液中添加左旋咪唑 (0.24 mg/ml Levamisole) 來抑制內源性磷酸酶活性。除此之外,若是使用 ABC (avidin-biotin complex) 檢測法,還需以含有大量抗生物素蛋白 (Avidin) 的阻斷液阻斷內源性生物素 (biotin);而若是使用螢光染色法,則是要注意甲醛固定液帶來的自體螢光 (autofluorescence) 問題,可以藉由在阻斷液中添加甘氨酸 (0.3M glycine) 來改善。
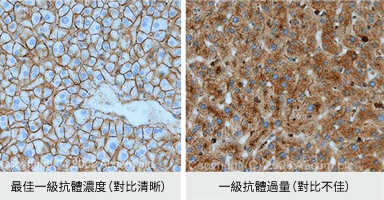
選擇一級抗體時,建議優先選用 IHC 實驗驗證抗體,並參照抗體說明書或文獻數據進行優化測試,以能夠呈現出最佳訊噪對比的稀釋比例作為抗體工作濃度。值得一提的是,Abcam 一般會使用 Antibody Diluent (ab64211) 來稀釋 IHC 實驗一級抗體,以減少抗體的非專一性結合與增加抗體穩定度。更重要的是,使用新鮮配製的抗體,並建議同時進行不加一抗只加二抗的對照組實驗。
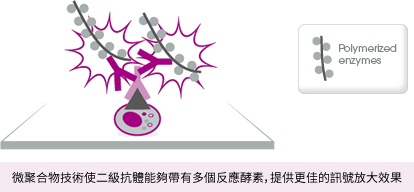
二級抗體的使用能夠帶來訊號放大效果,其中又以帶有微聚合物 (micropolymer) 的二級抗體具有最佳的訊號放大效果!因為微聚合物技術能讓二級抗體在帶有多個反應酵素的同時還保有良好的組織穿透性,因此能夠提供更佳的訊號放大效果,使靈敏度獲得有效提升,特別適合用來檢測表現量較低的蛋白質。
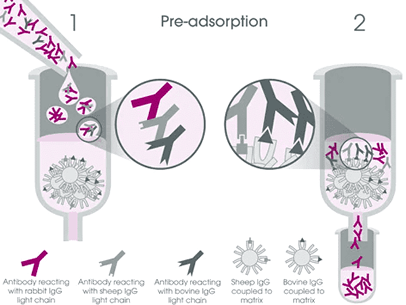
另一方面,針對使用螢光標定二級抗體進行多重染色 (multiplex IHC) 的科研人員,則是建議採用經過預吸附 (pre-adsorption) 或稱為交叉吸附 (cross-adsorption) 處理的二級抗體進行檢測。這類抗體具有高度專一性,可以降低交叉反應風險從而改善背景值過高的問題。您可以在此頁面找尋到所有預吸附二級抗體產品。
預吸附(交叉吸附)二級抗體。將二抗溶液通過固定有血清蛋白(源自可能發生交叉反應的物種)的層析管柱,非專一性二抗將保留在管柱內,高專一性的二抗則會流出管柱。經由此純化步驟所獲得的預吸附二級抗體具有高度專一性,可最大程度降低交叉反應風險,改善背景值過高的問題。 最後要提醒的是,如同一級抗體反應,在二級抗體反應環節同樣建議進行抗體稀釋比例優化與使用新鮮配製的抗體,避免抗體重複使用。
不久前我們曾經介紹過 IHC 實驗該選擇酵素呈色還是螢光染色?在此僅補充提醒,若是使用酵素呈色,要注意呈色劑必須新鮮配製,並在背景值過高時降低呈色劑濃度與縮短呈色時間;螢光染色則要注意切片的避光,並儘快完成影像擷取。
封片膠 (mounting media) 可以對組織切片與染色結果達到保護效果,同時也對成像品質有一定的影響性。封片膠可區分為水溶性 (aqueous) 與油溶性 (organic),基本上水溶性封片膠可以適用於所有類型的檢測試劑,例如 AEC、Fast Red、DAB 與螢光染料(螢光染色應選擇螢光檢測專用的水溶性封片膠),油溶性封片膠則適用於 DAB 呈色劑或 H&E 染色。封片時應注意不可有氣泡,並注意用量,以能夠均勻完整覆蓋所有組織區域為佳,不可過量,以免影響影像觀察。 以上就是 Abcam 在進行 IHC 實驗時會特別關注的一些小細節。在您進行日常 IHC 實驗時,歡迎下載使用【IHC 實驗檢查清單】,方便您隨時檢查是否遺漏了哪些關鍵點!若有任何疑問或技術支援需求,歡迎隨時洽詢 Abcam 台灣代理 — 伯森生技(👨💻線上聯絡伯森業務專員)。您可透過下方連結瀏覽更多相關資訊: |
||||||||||||||||||||||||||||||||||||||
 |
 |
|||||||||||||||||||||||||||||||||||||
伯森生物科技(股)公司 Blossom Biotechnologies, Inc.
網址 www.blossombio.com 客服 0800-059668
[ 📝 線上留言諮詢 ] [ ☎ 伯森業務專員聯絡資訊 ]